A propósito de las terapias avanzadas de un solo paciente
El mítico lema bajo el que vivían los mosqueteros Athos, Porthos y Aramis, junto a D'Artagnan, salidos de la fecunda imaginación del gran Alejandro Dumas, una frase que ha quedado como el mensaje más famoso de su novela Los tres mosqueteros, me sirve para titular esta reflexión sobre las terapias avanzadas de un solo paciente ("todos para uno") y lo que pueden estas limitadas terapias aportar al conjunto de pacientes con una determinada enfermedad ("uno para todos").
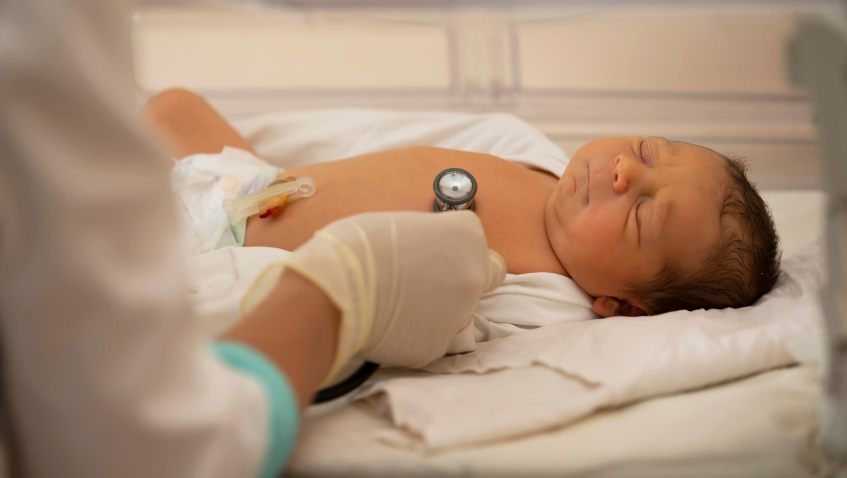
Acabamos de conocer a través de la mayoría de medios la noticia acerca del importante avance científico, publicado en la prestigiosa revista New England Journal of Medicine, logrado por el médico cardiólogo e investigador Kiran Musunuru, de la UPENN, y la médica pediatra Rebecca Ahrens-Nicklas y sus colegas del Hospital Infantil de Filadelfia (CHOP), sobre una terapia experimental basada en editores de bases (que son la segunda generación de herramientas CRISPR de edición genética, diseñadas por David R. Liu en 2016), desarrollada en un tiempo récord para tratar a un solo paciente, un niño nacido con mutaciones en el gen CPS1, que codifica la enzima carbamoil fosfato sintetasa I.
Las mutaciones en este gen resultan en una deficiencia en esta enzima, CPS1D, una enfermedad rara metabólica y muy grave que afecta a ~ 1:300.000 recién nacidos y está asociada a un ciclo de la urea alterado. El bloqueo se traduce en problemas para eliminar el amonio del cuerpo, dando lugar a una variedad de patologías y alteraciones neurológicas, tales como letargia, vómitos, hipotermia, crisis epilépticas y coma, causadas por esta toxicidad del amonio (hiperamonemia), que generalmente acaba con la muerte de aproximadamente el 50% de los recién nacidos con esta condición genética. Esta enfermedad no está incluida en el cribado neonatal (prueba del talón) mínimo indicado por el Ministerio de Sanidad en España. Los niños nacidos con esta deficiencia enzimática deben ser tratados inmediatamente con hemodiálisis, restringir su dieta en proteína, aumentar glúcidos y lípidos, y recibir aportes de arginina y citrulina, que son aminoácidos esenciales, y además administrar substancias que ayuden a eliminar el nitrógeno del cuerpo (como por ejemplo el benzoato sódico). A medio/largo plazo, para los niños que sobreviven, la terapia recomendada es el trasplante hepático, que sin embargo no evita las complicaciones neurológicas. Estamos pues ante una enfermedad muy grave, devastadora e incurable.
Kiran Musunuru no es un recién llegado en estas técnicas. Su equipo también lideró otro tratamiento experimental con editores de bases para inactivar el gen PCSK9, que codifica el represor del receptor de las lipoproteínas de baja densidad (LDL), que son las que transportan el colesterol por la sangre, y cuyo efecto terapéutico final es la disminución significativa del colesterol sérico como posible terapia para personas con hipercolesterolemia familiar. Musunuru también escribió un libro explicando el desgraciado experimento realizado por He Jiankui, conocido en noviembre de 2018, que terminó con la edición del genoma de tres niñas chinas. Kiran Musunuru participó en 2024 en una reunión organizada por The Royal Society donde se discutieron las terapias avanzadas basadas en las herramientas CRISPR de edición genética. Adicionalmente, Kiran Musunuru es fundador de una empresa (Verve Therapeutics) que persigue trasladar el uso de los editores de bases a terapias génicas en pacientes.

Hay que elogiar a estos médicos e investigadores de Filadelfia por desarrollar este tratamiento basado en editores de bases, personalizado para este niño con CPS1D, poco después de que se diagnosticara al recién nacido y se identificaran las dos mutaciones heredadas de sus padres. Una de las mutaciones podía tratarse con editores de bases ABE (una deaminasa que permite convertir una A en G). Estos científicos plantearon una estrategia terapéutica, la validaron en células y en un modelo animal en ratones, todo ello durante los primeros seis meses de vida del niño, y obtuvieron la autorización de la FDA para su tratamiento experimental compasivo. Con ello pudieron infundir en su torrente sanguíneo nanopartículas lipídicas (LNPs, las mismas que se usaron para las vacunas COVID-19 desarrolladas por Moderna o Pfizer/BioNTech) que encapsulaban dos ARNs, un ARN que codificaba la el editor de bases (proteína ABE) y otro ARN como guía que dirigía la proteína al sitio correcto de la mutación en el gen CPS1. Lo trataron dos veces, a los siete y ocho meses, con una celeridad sorprendente y encomiable.
Todo parece indicar que la terapia fue bien, ya que el niño comenzó a tolerar las proteínas en su dieta (antes le resultaban tóxicas) y, aunque sufrió varias infecciones virales no relacionadas con su enfermedad, las superó sin problemas y parece estar a salvo, sin las graves consecuencias que, de otro modo, presentaría debido a su enfermedad rara CPS1D. Por supuesto, se impone la prudencia, dado que pocos análisis se le han podido hacer al niño (no se le ha hecho una biopsia hepática). Se necesita más seguimiento para observar el progreso a medio y largo plazo de este tratamiento. Por ejemplo no se ha podido evaluar la posible modificación de este gen en células germinales (una de las preocupaciones principales de las agencias reguladoras, que sería ilegal en nuestro país, signatario del Convenio de Oviedo, que prohíbe la modificación del genoma de la descendencia), aunque los autores refieren que experimentos similares en ratones y macacos no han logrado detectar ediciones de genes en testículos u ovarios. Así que esperemos y deseemos lo mejor.

En estos momentos esta terapia para un solo paciente parece que ha sido un éxito incontestable. Solo hace falta leer la mayoría de comentarios publicados al respecto. Hay que señalar que el órgano diana que es el destinatario de este tratamiento para curar esta enfermedad (el hígado) es el más sencillo y, por el momento, el único que permite terapias con herramientas de edición genética CRISPR administradas in vivo, como se ha demostrado con CRISPR-Cas9 (por ejemplo, el tratamiento contra la amiloidosis por transtiretina, desarrollado por la empresa Intellia Therapeutics, fundada por Jennifer Doudna) y con editores de bases (p.e. la inactivación de PCSK9 desarrollada por Verve Therapeutics/Kiran Musunuru para pacientes con hipercolesterolemia familiar). Si el gen a editar tuviera una expresión en cualquier otro órgano su efectividad in vivo seguiría siendo problemática o, por el momento, inviable.
Científica y técnicamente, este es un gran logro. En muy poco tiempo (6 meses), los investigadores produjeron LNPs con ABE y un ARN guía específico para resolver la mutación del gen CPS1 desde cero, validaron el diseño experimental en células y ratones y estuvieron listos para tratar al bebé lo antes posible para evitar las consecuencias indeseadas de esta enfermedad metabólica. Sin embargo, se trata de una terapia para un solo paciente. Con este tipo de terapias, solo se puede celebrar su éxito. Si no funcionan, no se puede interpretar ningún fallo, ya que no se tienen en cuenta variables ni controles, ni se tiene con qué comparar. Por lo tanto, metodológicamente, las terapias para un solo paciente deben estar muy bien pensadas y diseñadas, ya que no hay margen para el error. Si fallan, no hay suficiente información para determinar dónde podría estar el problema. Esta es una limitación importante.
Además, en mi humilde opinión, las terapias para un solo paciente también pueden ser injustas y éticamente cuestionables para el resto de las familias con hijos que padecen la misma enfermedad. Se destinan enormes recursos a tratar a un solo paciente ("todos para uno"). Estas terapias son tan personalizadas y están diseñadas tan específicamente para una mutación determinada que no pueden utilizarse para otros niños con la misma enfermedad rara, pero portadores de otras mutaciones. Naturalmente que el éxito de estas terapias de un solo paciente permite albergar esperanzas a otras familias que aspiran a participar del éxito futuro de estos tratamientos ("uno para todos"). Esto es así, lo sabemos, no debería sorprendernos, pero sería deseable que se desarrollaran terapias que llegaran a la mayoría, si no a todos, los niños con la misma enfermedad rara. Idealmente.

Si eres el padre o la madre del niño KJ, el recién nacido tratado en Filadelfia, estarás eternamente agradecido a los investigadores responsables de esta terapia experimental que ha salvado la vida a tu hijo. Pero si eres el padre o la madre de otro niño, con la misma enfermedad rara grave, que no ha tenido la suerte de ser elegido para el desarrollo de esta terapia de un solo paciente, y si sabes que no hay financiación suficiente para desarrollar terapias similares para tu hijo y para los de otros con la misma enfermedad, te cuestionarás si tal inversión masiva para salvar a un solo niño está justificada plenamente o no. Salvar una vida no tiene precio... ¿o sí? Este es un debate incómodo, políticamente incorrecto, que se orilla, pero que sin embargo deberemos afrontar tarde o temprano.
Todos deberíamos celebrar la aparente cura y bienestar de este niño, cuya enfermedad muy grave ha sido detenida gracias a este tratamiento experimental. Pero se trata de un solo paciente (asumiendo una población aproximada de >300.000.000 en EEUU, cabe suponer que hay más de un millar de niños con CPS1D nacidos en EE.UU.). De ahí que las preguntas relevantes ahora, en mi opinión, sean: ¿Cuáles son las posibilidades de exportar este tratamiento (adaptado a otras mutaciones) a otros niños de todo el mundo con la misma enfermedad? ¿Cuál es la accesibilidad y asequibilidad de estas terapias en su conjunto? Estos también son aspectos importantes a tener en cuenta. De lo contrario, podríamos distraer y confundir a las asociaciones de pacientes al anunciar este éxito espectacular de las terapias personalizadas, que sin embargo resultará decepcionante para el resto de las familias, una vez comprendan que, actualmente, no habrá terapias similares disponibles de inmediato para todos ellos. El éxito individual combinado con el fracaso social. Tremendamente difícil de resolver.
Necesitamos economistas e ingenieros, además de médicos e investigadores, capaces de optimizar, aligerar, abaratar y adaptar los protocolos terapéuticos para hacerlos más accesibles y más asequibles. Que estén disponibles para todas las familias, todas las personas que los necesiten. De otra manera seguiremos vulnerando el cuarto principio de la bioética, el principio de justicia, que nos recuerda (en una de sus diversas acepciones) que todas las terapias que desarrollemos deben servir para todas las personas que las necesitan, no solamente para aquellas que puedan sufragarlas.
Los autores de esta terapia pionera anticipan un futuro en el que estas terapias personalizadas estarán disponibles habitualmente para todos los pacientes que requieran la corrección de un gen. Aunque espero que esto sea cierto, me temo que debo reconocer que aún estamos lejos de este horizonte. Los elevados costes asociados a todas estas terapias impiden actualmente su uso universal o la adopción de estos tratamientos por parte de los Sistemas Nacionales de Salud (en aquellos países donde el sistema de salud cubre a toda la población, como el nuestro).
Como estrategias complementarias a esta terapia experimental, deberíamos proponer la inclusión de esta enfermedad (CPS1D) en la prueba del talón, en el cribado neonatal. Adicionalmente, ante la sospecha de parejas portadoras de mutaciones en este gen (que son recesivas) deberíamos facilitar el DGP (diagnóstico genético preimplantacional, para detectar embriones obtenidos por fecundación in vitro con las dos mutaciones) que siempre resultará más asequible y accesible que el desarrollo de una terapia individualizada.
Dr. Lluís Montoliu
CNB-CSIC y CIBERER-ISCIII, Madrid